Новое исследование в Nature-Cancer успешно предотвратило рост нейробластомы у мышей путем модификации CAR-T-клеток. Это означает, что CAR-T-клетки, которые обычно хорошо влияют только на гематологические опухоли, также могут играть роль в солидных опухолях.
Это не только означает, что нейробластому можно лечить с помощью CAR-T, и, если следовать идеям исследования, возможно, ограничение CAR-T в солидных опухолях, наконец, будет нарушено.
Нам необходимо знать, что самый основной рецептор химерного антигена обычно образуется путем слияния внеклеточного опухолевого антигенсвязывающего домена и внутриклеточной цепи CD3-ζ. Первые могут помочь Т-клеткам нацеливаться на опухоли, а вторые могут подавать сигналы иммунной инициации.
Тогда есть два способа улучшить функцию CAR-T. Один из них заключается в увеличении зоны распознавания внеклеточного антигена для повышения способности охотиться за опухолями; другой - усиление внутренних сигналов для поддержания роста и метаболизма Т-клеток. Пусть дольше существует в теле.
Первое легче понять, потому что обычно на поверхности опухолевых клеток находится множество антигенов, и CAR-T-клетки обычно могут распознавать некоторые из этих антигенов после модификации для атаки на мишень. Нам нужно только добавить внешние мишени, которые атакуют разные антигены одновременно, чтобы улучшить противораковые свойства CAR-T. Это также недавно появившаяся концепция двойного нацеливания CAR-T.
По сравнению с CAR-T-клетками, которые распознают только один антиген, эти T-клетки с двойной мишенью могут более эффективно отслеживать местонахождение раковых клеток и предотвращать их уклонение от иммунной системы.
Для внутренней модификации в последние несколько поколений итераций обновления технологии CAR химерные антигенные рецепторы в основном добавляли некоторые костимулирующие молекулы, включая CD28 и 4-1BB и т. Д., Костимулирующие молекулы могут поддерживать и усиливать функцию CAR-T и способность к пролиферации.
Однако прошлые исследования с использованием одной костимулирующей молекулы на химерных рецепторах с двойной мишенью показали, что это не может контролировать рост опухоли в течение длительного времени и не может решить проблему солидных опухолей. Поэтому исследовательская группа из Университета Северной Каролины решила вводить сигналы двух костимулирующих молекул одновременно и переносить их на разные рецепторы с двойной мишенью для дальнейшего повышения способности клеток CAR-T.

В исследовании использовалась нейробластома в качестве тестовой мишени, и клетки CAR-T также несли целевые связывающие области опухолевых антигенов GD2 и B7-H3, и каждый из двух химерных рецепторов несли костимулирующую молекулу CD28 или 4-1BB. Эта двойная мишень-двойной сигнал CAR-T может полностью убивать клетки in vitro после совместного культивирования с нейробластомой.
В эксперименте на мышах исследователи ввели клетки нейробластомы мышам, и у мышей, использующих только один антиген-мишень, вскоре после этого возникнет рецидив опухоли. Однако предыдущие поколения методов CAR-T не могут предотвратить процесс рецидива опухоли. Только клетки CAR-T с двойной мишенью и двойным сигналом могут достичь этой цели и контролировать рост опухоли.
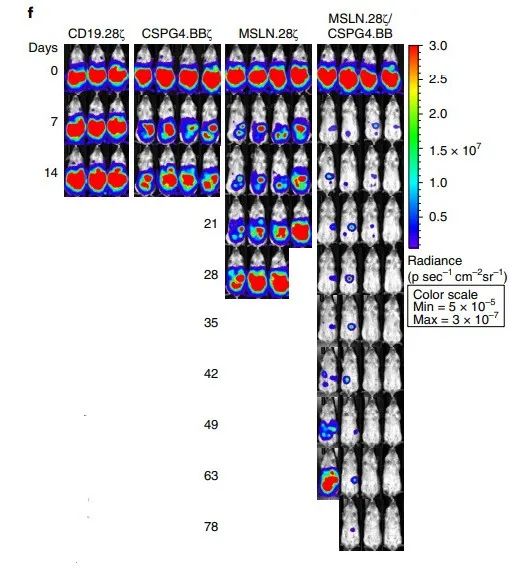
И мыши, получающие новую терапию, все еще могут достичь эффекта контроля над опухолью, даже если они подвергаются процессу повторной стимуляции опухоли. Результаты испытаний показывают, что после 2 и 4 недель лечения у мышей все еще могут быть обнаружены высокие уровни CAR-T-клеток с двойной мишенью и двойным сигналом. Это означает, что такие клетки могут существовать в организме вечно.
Судя по результатам испытаний, это преимущество может быть связано с взаимной помощью двух сигналов в ячейке. Например, химерный рецептор CD28 и 4-1BB может улучшать сигнальный эффект CD3-ζ и усиливать метаболизм и пролиферацию Т-клеток.
В целом, исследование предлагает новую идею использования CAR-T для лечения солидных опухолей. Однако конкретные костимулирующие молекулы, которые будут использоваться, необходимо определять в соответствии с различными средами опухоли.